Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - Ocena Ryzyka Zawodowego metodą PN-N-18002
Spis treści
- Opis - ryzyko zawodowe - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Charakterystyka stanowiska - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Ocena ryzyka zawodowego COVID-19
- Zawartość dokumentacji ryzyka zawodowego
- Opis zawodu - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Obowiązki na stanowisku pracy Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Dostępne wersje oceny ryzyka zawodowego
- Materiały video - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Podgląd oceny ryzyka zawodowego Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Opis metody PN-N-18002
- Przykładowe zagrożenie Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Parametry techniczne
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego – ryzyko zawodowe
 Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - Ocena Ryzyka Zawodowego metodą PN-N-18002 to wyjątkowa dokumentacja, która ściśle określa ryzyko zawodowe na podanym stanowisku. Jest to kompleksowo przygotowana przez wybitnych specjalistów ocena ryzyka zawodowego oraz opracowana, wzorcowa dokumentacja dla osoby zatrudnionej na stanowisku inspektora do spraw wytwarzania głównego inspektoratu farmaceutycznego.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - Ocena Ryzyka Zawodowego metodą PN-N-18002 to wyjątkowa dokumentacja, która ściśle określa ryzyko zawodowe na podanym stanowisku. Jest to kompleksowo przygotowana przez wybitnych specjalistów ocena ryzyka zawodowego oraz opracowana, wzorcowa dokumentacja dla osoby zatrudnionej na stanowisku inspektora do spraw wytwarzania głównego inspektoratu farmaceutycznego.
Charakterystyka zawodu - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego jest odpowiedzialny za nadzorowanie procesów produkcji leków i innych produktów farmaceutycznych w zakładach farmaceutycznych. Jego głównym celem jest zapewnienie zgodności z obowiązującymi przepisami i standardami jakości, aby produkty były bezpieczne dla pacjentów.
Do obowiązków Inspektora do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego należy przeprowadzanie inspekcji w zakładach produkcyjnych, analizowanie dokumentacji technicznej dotyczącej procesów wytwarzania, ocenianie systemów kontroli jakości oraz raportowanie znalezionych nieprawidłowości. Ponadto może on udzielać wsparcia i konsultacji producentom farmaceutycznym w celu poprawy procesów wytwarzania.
Praca Inspektora do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego odbywa się głównie w biurze, jednak wymaga także regularnych wizyt w zakładach produkcyjnych. Inspektor może korzystać z różnego rodzaju narzędzi i urządzeń, takich jak komputery, oprogramowanie do analizy danych, termometry, czy próbniki do pobierania próbek.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego – Ocena ryzyka zawodowego COVID-19
 Zgodnie z najnowszymi wytycznymi Państwowej Inspekcji Pracy oraz Państwowej Inspekcji Sanitarnej nasza dokumentacja została zaktualizowana i rozbudowana o zagrożenie związane z koronawirusem SARS-CoV-2 (COVID-19).
Kupując niniejszą dokumentację możesz mieć pewność, że bez problemu przejdzie ona kontrolę, a treść w będąca przedmiotem tego produktu jest jak najbardziej aktualna w odniesieniu do aktualnych przepisów pracy.
Zgodnie z najnowszymi wytycznymi Państwowej Inspekcji Pracy oraz Państwowej Inspekcji Sanitarnej nasza dokumentacja została zaktualizowana i rozbudowana o zagrożenie związane z koronawirusem SARS-CoV-2 (COVID-19).
Kupując niniejszą dokumentację możesz mieć pewność, że bez problemu przejdzie ona kontrolę, a treść w będąca przedmiotem tego produktu jest jak najbardziej aktualna w odniesieniu do aktualnych przepisów pracy.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego ocena ryzyka
 Ocena ryzyka zawodowego na stanowisku Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego została przygotowana w oparciu o metodę wg. Polskiej Normy PN-N-18002. Metoda PN-N-18002 jest powszechnie znaną metodą szacowania ryzyka zawodowego. Została ona utworzona w Polsce i jest często stosowana w kraju. Jest uznawana oraz rekomendowana przez organy kontrolujące, między innymi Państwową Inspekcję Pracy, czy Państwową Inspekcję Sanitarną. Co więcej, metoda w polecanej publikacji pokazana jest w bardzo przystępny oraz obrazowy sposób. W dokumentacji zastosowano liczne kolorowe tabelki wartościowania określonych parametrów (skutki czy prawdopodobieństwo wystąpienia zdarzenia), taka prezentacja niezbędnych dokumentów pozwoli na bezproblemowy przebieg kontroli przeprowadzony przez organy kontrolujące. Dokumentacja jest bardzo przejrzysta oraz przygotowana w sposób wyczerpujący tematykę zagrożeń dla inspektora do spraw wytwarzania głównego inspektoratu farmaceutycznego. Jest to kompleksowa ocena ryzyka zawodowego Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego. Publikacja Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - ocena ryzyka zawodowego to gwarancja pozytywnego przejścia kontroli z Państwowej Inspekcji Pracy, czy Państwowej Inspekcji Sanitarnej. Metoda PN-N-18002 dla stanowiska Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego została wykorzystana w skali pięciostopniowej. Oznacza to, iż dokumentacja obejmuje rozszerzone wartościowanie ryzyka, co przekłada się na jej większą dokładność. Zakup produktu to pewność poprawnie przygotowanej dokumentacji.
Ocena ryzyka zawodowego na stanowisku Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego została przygotowana w oparciu o metodę wg. Polskiej Normy PN-N-18002. Metoda PN-N-18002 jest powszechnie znaną metodą szacowania ryzyka zawodowego. Została ona utworzona w Polsce i jest często stosowana w kraju. Jest uznawana oraz rekomendowana przez organy kontrolujące, między innymi Państwową Inspekcję Pracy, czy Państwową Inspekcję Sanitarną. Co więcej, metoda w polecanej publikacji pokazana jest w bardzo przystępny oraz obrazowy sposób. W dokumentacji zastosowano liczne kolorowe tabelki wartościowania określonych parametrów (skutki czy prawdopodobieństwo wystąpienia zdarzenia), taka prezentacja niezbędnych dokumentów pozwoli na bezproblemowy przebieg kontroli przeprowadzony przez organy kontrolujące. Dokumentacja jest bardzo przejrzysta oraz przygotowana w sposób wyczerpujący tematykę zagrożeń dla inspektora do spraw wytwarzania głównego inspektoratu farmaceutycznego. Jest to kompleksowa ocena ryzyka zawodowego Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego. Publikacja Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - ocena ryzyka zawodowego to gwarancja pozytywnego przejścia kontroli z Państwowej Inspekcji Pracy, czy Państwowej Inspekcji Sanitarnej. Metoda PN-N-18002 dla stanowiska Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego została wykorzystana w skali pięciostopniowej. Oznacza to, iż dokumentacja obejmuje rozszerzone wartościowanie ryzyka, co przekłada się na jej większą dokładność. Zakup produktu to pewność poprawnie przygotowanej dokumentacji.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
zawartość oceny ryzyka zawodowego
![[[wzor]] - wzory dokumentow bhp](media/uploads/wzory-dokumentow-bhp.webp)
- Strona tytułowa.
- Pełna karta stanowiska pracy: (opis czynności, ogólna charakterystyka, używane maszyny i narzędzia na stanowisku pracy Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego, sposób i miejsce wykonywania pracy).
- Dokładny opis metody wraz z matrycą mierzenia ryzyka - PN-N-18002.
- Identyfikacja zagrożeń - pełen wykaz czynników z odpowiednim ich podziałem (fizyczne, pyły i pary, chemiczne, biologiczne, uciążliwe i niebezpieczne).
- Szczegółowe karty zagrożeń dla Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego zawierające pełne szacowanie ryzyka metodą PN-N-18002
- Wykaz działań korygujących zagrożenia oraz odpowiedzialności za to.
- Wykaz pracowników zatrudnionych na danym stanowisku.
- Dokumentacja składa się z około 25 stron w fotmacie A4.
Opis zawodu - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
Wykonuje zadania z zakresu nadzoru nad warunkami wytwarzania i importu produktów leczniczych, badanych produktów leczniczych i substancji czynnych wykorzystywanych jako materiały wyjściowe przeznaczone do wytwarzania produktów leczniczych zgodnie z wymaganiami Dobrej Praktyki Wytwarzania oraz nad jakością produktów leczniczych.
Obowiązki na stanowisku pracy Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
- Inspekcje warunków wytwarzania importu produktów leczniczych i badanych produktów leczniczych;
- Inspekcje warunków wytwarzania, przetwarzania i przerobu środków odurzających, prekursorów oraz substancji psychotropowych;
- Inspekcje warunków wytwarzania substancji czynnych wykorzystywanych jako materiały wyjściowe przeznaczone do wytwarzania produktów leczniczych;
- Opracowywanie raportów z przeprowadzanych inspekcji;
- Pobór prób produktów leczniczych do badań laboratoryjnych;
- Akceptacja harmonogramów działań naprawczych;
- Wnioskowanie do głównego inspektora farmaceutycznego w sprawie udzielenia/zmiany/cofnięcia lub odmowy udzielenia zezwolenia na wytwarzanie i import produktów leczniczych;
- Wnioskowanie głównego inspektora farmaceutycznego o wydanie bądź odmowę wydania certyfikatu dobrej praktyki wytwarzania;
- Wnioskowanie głównego inspektora farmaceutycznego o wydanie decyzji nakazującej usunięcie stwierdzonych niezgodności w wyznaczonym terminie lub unieruchomienie wytwórni lub jej części;
Dostępne wersje oceny ryzyka dla Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego:
- Elektroniczna (.doc/.docx/.odt/.pdf) - daje możliwość dokonywania zmian w dokumentacji w razie zajścia takiej potrzeby.
- Papierowa - gotowy wydruk przygotowany do podpisu przez pracodawcę i pracownika w miękkiej oprawie.


![Grzegorz Wrzeszcz - [[nazwa_full]]](media/uploads/grzegorz-wrzeszcz-instrukcja.webp)
Cześć!
Nazywam się Grzegorz Wrzeszcz i od 2014 roku zawodowo zajmuję się BHP. Od tego czasu udało mi się opracować blisko 1500 różnych dokumentacji oceny ryzyka zawodowego metodą PN-N-18002 w tym również ryzyko zawodowe dla stanowiska Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego, które możesz zakupić na tej stronie.
Jeżeli masz jakieś pytania odnośnie tego produktu to pisz śmiało lub dzwoń! Z przyjemnością odpowiem na wszystkie twoje pytania i rozwieję (mam nadzieję) wszelkie wątpliwości.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego – materiały wideo o ryzyku zawodowym
Co to jest ocena ryzyka zawodowego?
Jeśli chcesz się dowiedzieć, czym jest ocena ryzyka zawodowego, dlaczego jest tak ważna i jak ją przeprowadzić w praktyce, koniecznie obejrzyj nasz film! Dowiesz się, jakie korzyści płyną z rzetelnej analizy zagrożeń i jak zwiększyć bezpieczeństwo pracowników w Twojej firmie.
Dowiedz się jak działa metoda PN-N-18002
Jeśli chcesz się dowiedzieć, jak działa metoda PN-N-18002 i dlaczego może być kluczowa w procesie oceny ryzyka zawodowego, koniecznie obejrzyj nasz film! Zrozumiesz, jak poszczególne etapy analizy i standaryzacja pomagają w identyfikacji zagrożeń oraz w planowaniu środków zapobiegawczych. Przekonaj się, jak PN-N-18002 może zwiększyć skuteczność działań w Twojej firmie.
Kogo dotyczy ocena ryzyka zawodowego?
Jeśli chcesz się dowiedzieć, kogo dotyczy ocena ryzyka zawodowego, jak wpływa na różne grupy pracowników i kto powinien być zaangażowany w ten proces, koniecznie obejrzyj nasz film! Dowiesz się o obowiązkach i prawach pracowników oraz pracodawców, a także o tym, jak prawidłowo przeprowadzona ocena ryzyka może przynieść korzyści Twojej organizacji.
Rodzaje i przykłady zagrożeń w ocenie ryzyka zawodowego
Jeśli chcesz się dowiedzieć, jakie rodzaje zagrożeń najczęściej pojawiają się w środowisku pracy i poznać ich konkretne przykłady, koniecznie obejrzyj nasz film! Zobaczysz, jak właściwe rozpoznanie zagrożeń jest kluczem do skutecznej oceny ryzyka zawodowego i zwiększenia bezpieczeństwa pracowników. Dowiedz się, które obszary wymagają szczególnej uwagi oraz jak im przeciwdziałać w praktyce.
Kto jest odpowiedzialny za ocenę ryzyka zawodowego?
Jeśli chcesz się dowiedzieć, kto jest odpowiedzialny za ocenę ryzyka zawodowego i jaką rolę odgrywają w tym procesie pracodawcy, specjaliści BHP oraz sami pracownicy, koniecznie obejrzyj nasz film! Zrozumiesz, dlaczego współpraca wszystkich zaangażowanych stron jest kluczem do skutecznej ochrony zdrowia i życia w miejscu pracy. Dowiedz się, jak jasno określić obowiązki i kompetencje, by zapewnić najwyższy poziom bezpieczeństwa w Twojej firmie.
Jak powstaje ocena ryzyka zawodowego?
Jeśli chcesz się dowiedzieć, jak krok po kroku powstaje ocena ryzyka zawodowego, koniecznie obejrzyj nasz film! Zobaczysz, jak w praktyce przebiega identyfikacja zagrożeń, analiza ich skutków oraz podejmowanie działań zapobiegawczych. Odkryj, jak rzetelnie przeprowadzony proces oceny ryzyka może wzmocnić bezpieczeństwo w Twojej firmie.
PODGLĄD - Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego
ryzyko zawodowe PN-N-18002


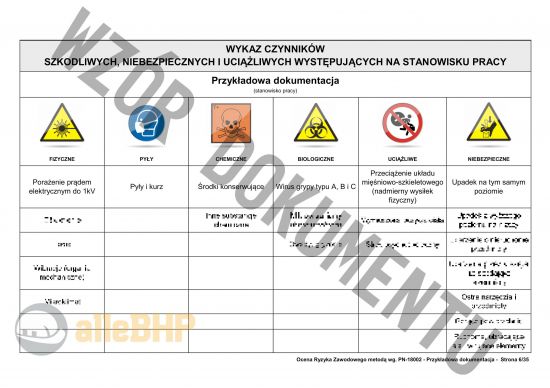
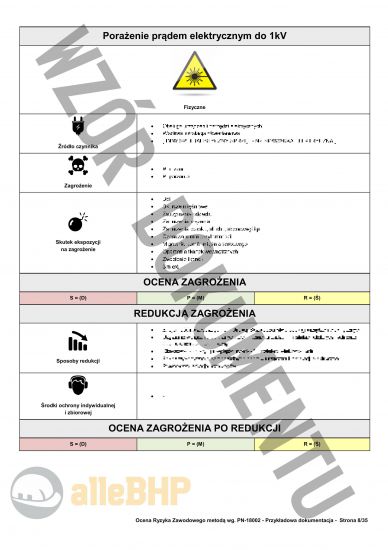
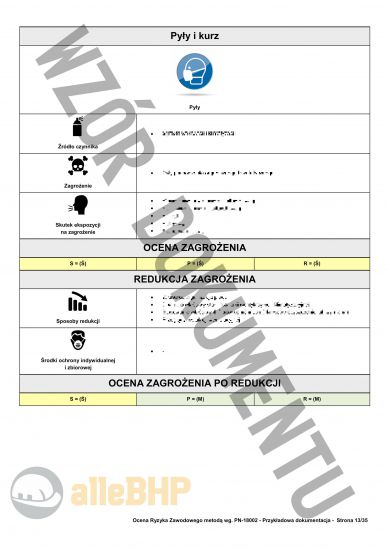
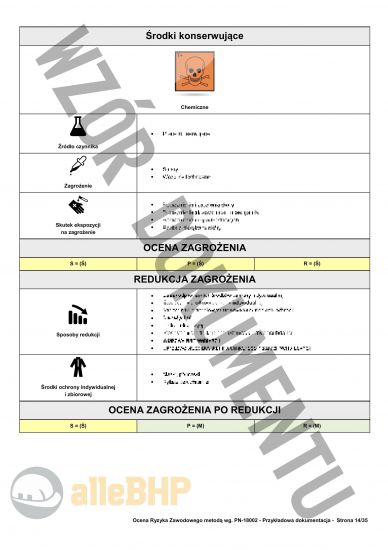
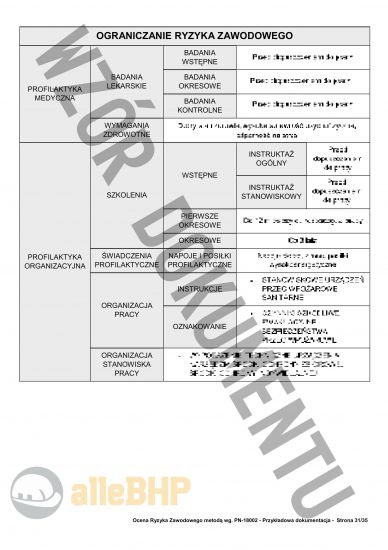
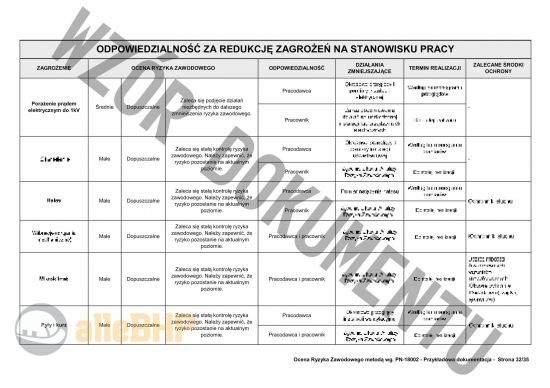

Przedstawiony podgląd dokumentacji ma charakter orientacyjny, którego celem jest unaocznienie jak skonstruowany jest plik który można zakupić,
a zakupiona dokumentacja będzie sie od niego znacząco różnić wartością merytoryczną.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - opis metody PN-N-18002
Metoda PN-N-18002 stanowi ujednolicony sposób oceny ryzyka zawodowego, opracowany w ramach polskich norm, który pozwala na systematyczną identyfikację i klasyfikację zagrożeń występujących w środowisku pracy. Wykorzystanie skali pięciostopniowej umożliwia precyzyjne określenie poziomu ryzyka, co jest kluczowe przy podejmowaniu decyzji o wdrożeniu działań prewencyjnych. Dzięki standaryzacji procedury, metoda ta gwarantuje porównywalność wyników oceny między różnymi zakładami pracy oraz ułatwia monitorowanie efektywności wprowadzonych środków bezpieczeństwa.
Podejście oparte na pięciostopniowej skali pozwala na zróżnicowaną analizę ryzyka, gdzie każdy stopień odzwierciedla rosnący poziom zagrożenia. Metoda ta integruje zarówno analizę czynników technicznych, jak i organizacyjnych, co umożliwia kompleksowe spojrzenie na warunki pracy. Ustrukturyzowany charakter PN-N-18002 ułatwia nie tylko identyfikację potencjalnych zagrożeń, ale również priorytetyzację działań naprawczych, co stanowi solidną podstawę dla dalszych, szczegółowych analiz i wdrażania rozwiązań zwiększających bezpieczeństwo w miejscu pracy.
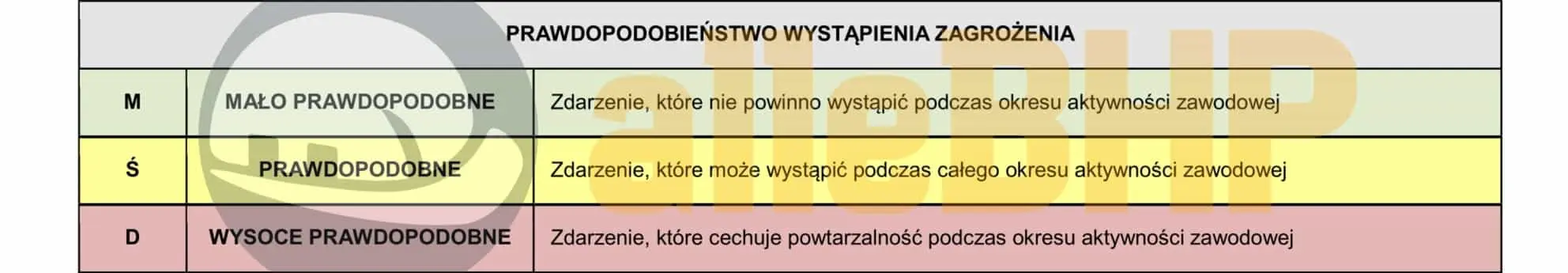
Prawdopodobieństwo (P)
Prawdopodobieństwo określa szansę wystąpienia niepożądanego zdarzenia podczas wykonywania pracy. Uwzględnia czynniki takie jak częstotliwość zagrożenia, warunki pracy, stosowane środki ochrony czy poziom wyszkolenia pracowników. Im wyższe prawdopodobieństwo, tym większe ryzyko zdarzenia.
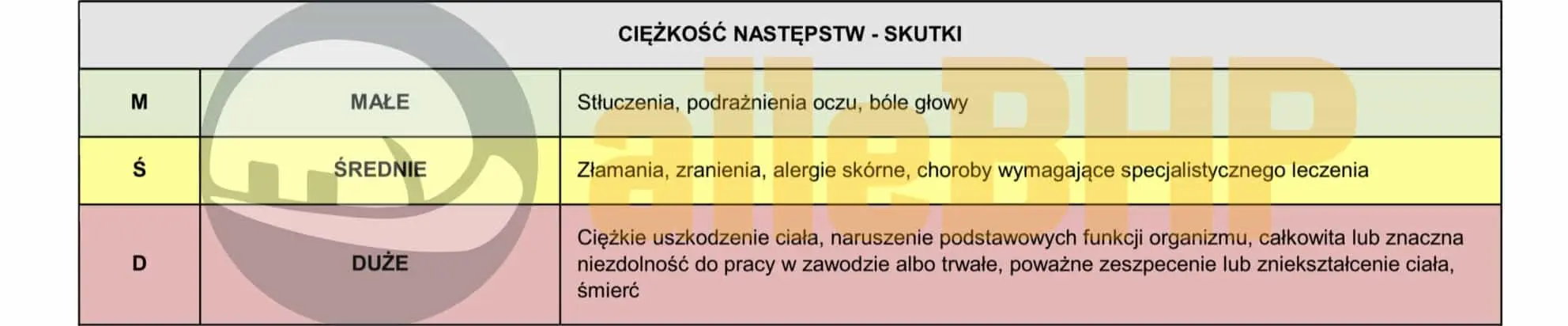
SKUTKI (S)
Skutki określają potencjalny poziom szkód wynikających z zaistnienia zdarzenia niebezpiecznego w środowisku pracy. Ocenia się je pod względem wpływu na zdrowie lub życie pracownika, środowisko oraz mienie, biorąc pod uwagę zarówno drobne obrażenia, jak i poważne wypadki lub straty. Im poważniejsze możliwe konsekwencje, tym wyższa wartość parametru S.
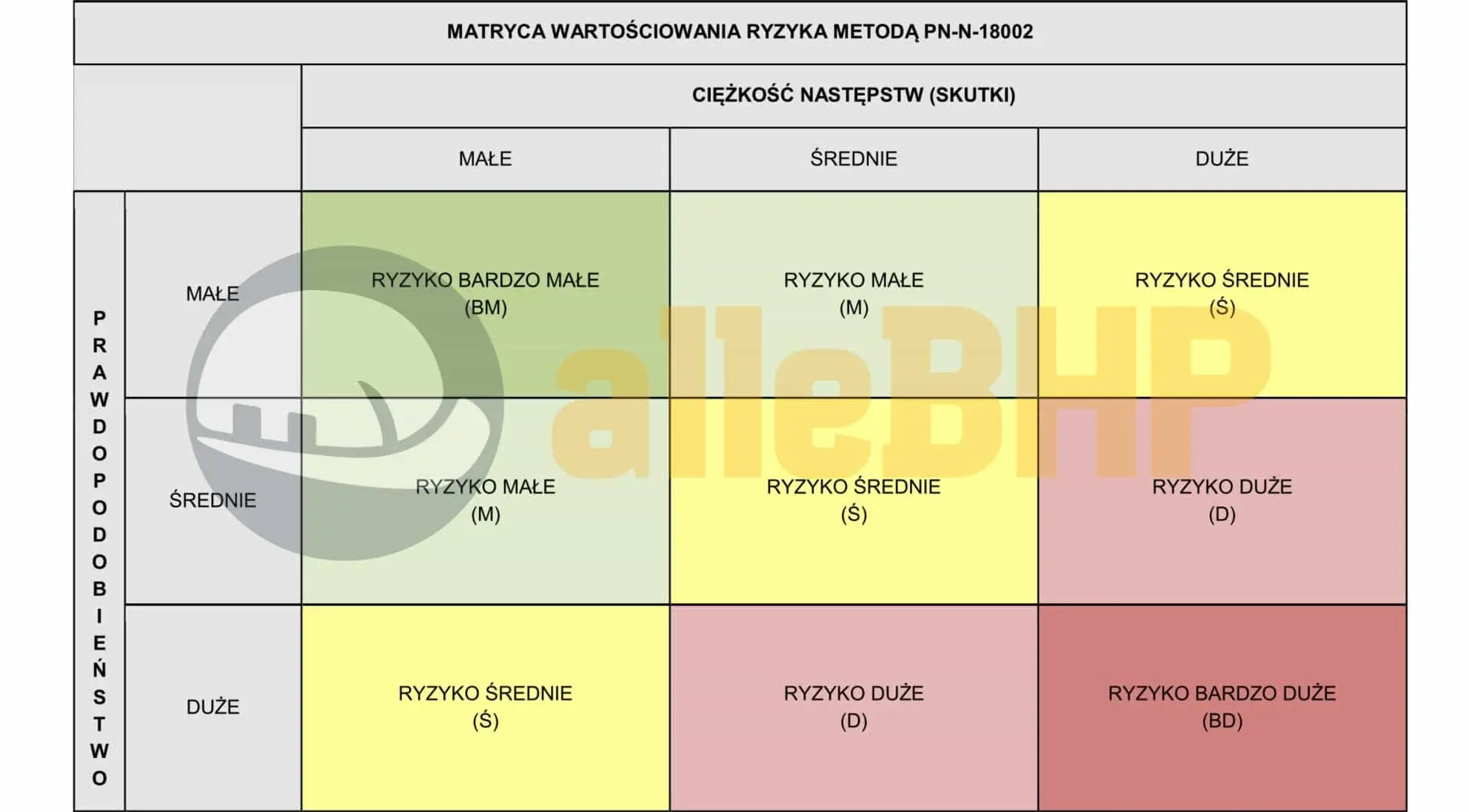
RYZYKO (R)
Ryzyko (R) w metodzie PN-N-18002 to miara poziomu zagrożenia związanego z wykonywaniem określonej pracy, uwzględniająca zarówno prawdopodobieństwo wystąpienia zdarzenia niebezpiecznego, jak i skalę jego potencjalnych skutków. Określa ono stopień narażenia pracownika na ryzyko oraz pomaga w ocenie, czy konieczne jest wdrożenie działań prewencyjnych lub ograniczających zagrożenie. Wyższa wartość ryzyka oznacza większe zagrożenie i wymaga pilniejszych środków ochronnych.
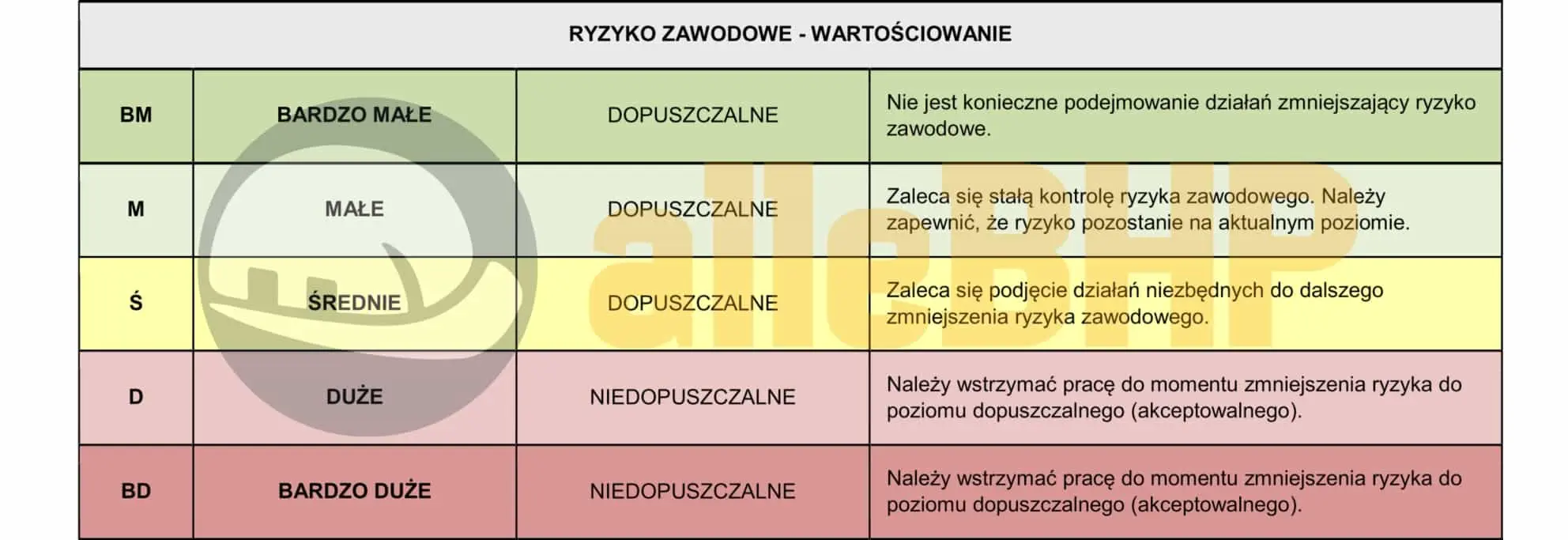
OCENA RYZYKA PN-N-18002
Metoda PN-N-18002 opiera się na pięciostopniowej skali oceny ryzyka zawodowego, w której wyróżnia się kategorie od bardzo małego (BM) do bardzo dużego (BD). W zależności od poziomu ryzyka tabela wskazuje różne zalecenia – od braku konieczności podejmowania działań w przypadku ryzyka bardzo małego, po natychmiastowe przerwanie pracy i wdrożenie środków redukujących zagrożenie przy ryzyku dużym i bardzo dużym. Dzięki temu przedsiębiorstwa mogą świadomie i efektywnie zarządzać bezpieczeństwem, koncentrując się na priorytetowych obszarach wymagających natychmiastowej interwencji. W rezultacie metoda PN-N-18002 wspiera ciągłe doskonalenie warunków pracy i minimalizowanie potencjalnych zagrożeń.
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - Przykładowe zagrożenie
Nazwa zagrożenia: Porażenie prądem elektrycznym do 1kV
Źródło zagrożenia: Obsługa urządzeń pod napięciem
Możliwe skutki: Ból, Skurcze mięśniowe, Zatrzymanie oddechu, Zaburzenia krążenia, Zaburzenia wzroku, słuchu, równowagi itp., Czasowa utrata przytomności, Migotanie komór mięśnia sercowego, Oparzenia tkanek wewnętrznych, Zwęglenie tkanek, Śmierć
Ciężkość następstw - skutki (S): D - Duże
Prawdopodobieństwo (P): M - Mało prawdopodobne
Ryzyko (R): Ś - Średnie
Oznacza to, że na stanowisku Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego według metody PN-N-18002 ryzyko jest ŚREDNIE i uznaje się je za dopuszczalne - Zaleca się podjęcie działań niezbędnych do dalszego zmniejszenia ryzyka zawodowego.
Opisane powyżej tabele wartościowania oraz opis metody znajdziesz w zakupionej Ocenie Ryzyka Zawodowego dla zawodu Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego metodą PN-N-18002.
Parametry techniczne
| Tytuł publikacji | Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - Ocena Ryzyka Zawodowego metodą PN-N-18002 |
| Producent, autor | alleBHP.pl, Grzegorz Wrzeszcz |
| Stanowisko | Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego |
| Kod zawodu | 242207 - zgodnie z rozporządzeniem Ministra Pracy i Polityki Społecznej z dnia 7 sierpnia 2014 r. (Dz. U. z 2014 r. , poz. 1145) |
| Metoda opracowania | PN-N-18002 - Polska Norma w skali pięciostopniowej |
| Format | Standard A4 - 21 x 29,7 cm |
| Liczba stron | około 25 stron formatu A4 |
| Dział, kategoria | Ocena ryzyka zawodowego, Specjaliści do spraw ekonomicznych i zarządzania |
| Wersja elektroniczna | Plik DOCX - umożliwia edycję dokumentacji w programie Microsoft Office |
| Dostępność wersji elektronicznej | W ciągu 5 minut od dokonania zakupu |
| Wersja papierowa (książkowa) |
|
| Dostępność wersji papierowej | Dostępna od ręki, wysyłka w 24h |
| Zgodność | Opracowana zgodnie z obowiązującymi przepisami dot. Oceny Ryzyka Zawodowego (Ustawa z dnia 26 czerwca 1974 r. – Kodeks pracy; Rozporządzenie Ministra Pracy i Polityki Socjalnej z dnia 26 września 1997 r. w sprawie ogólnych przepisów bezpieczeństwa i higieny pracy). Dokumentacja w pełni akceptowalna przez Państwową Inspekcję Pracy oraz Państwową Inspekcję Sanitarną. |
| Ocena klientów | - ponad 99% pozytywnych opinii |
Ocena ryzyka zawodowego
Zamawiając od nas dokumenrację oceny ryzyka zawodowego w wersji elektronicznej otrzymasz do pobrania dwa pliki:- Wersja graficzna - rozszerzony widok dokumentacji ryzyka zawodowego z ikonografią i rozbiciem każdego zagrożenia na osobnej stronie
- Wersja klasyczna - podstawowy widok dokumentacji ryzyka zawodowego w formie tabelki zbiorczej ze wszystkimi zagrożeniami - wersja ta składa się z około połowy objętości wersji graficznej
W przypadku zamówienia wersji papierowej, drukujemy i wysyłamy wersję klasyczną.
ocena ryzyka zawodowego inspektora do spraw wytwarzania głównego inspektoratu farmaceutycznego
 Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego ocena ryzyka zawodowego metodą PN-N-18002 uzyskał wiele pozytywnych opinii w branży. Dokumentacja została przygotowana w sposób rzetelny, dokładny, a co najważniejsze, zgodnie z obecnymi przepisami oraz wytycznymi. Produkt spełnia swoje zadanie, żadna z osób, która zakupiła prezentowaną dokumentację nie została ukarana przez organ kontrolujący jakimkolwiek mandatem. Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego ryzyko zawodowe metodą PN-N-18002 to godny polecenia produkt przygotowany przez specjalistów, którzy bardzo dobrze znają branżę BHP i posiadają spore doświadczenie w przygotowaniu różnych dokumentacji oceny ryzyka zawodowego metodą PN-N-18002 i nie tylko. Co więcej, produkt dostępny jest w dwóch wariantach: elektronicznym oraz drukowanym. Tylko od Ciebie zależy, na który wariant się zdecydujesz. Wariant elektroniczny umożliwia edycję pliku oraz wielokrotny wydruk, co ważne, dokumentację można pobrać już w kilka minut po zakupie. Na życzenie klienta istnieje możliwość wysłania plików w formacie PDF lub OpenOffice. Wariant drukowany to natomiast wersja dokumentacji, która jest gotowa do przedstawienia w czasie kontroli. Wymaga jedynie podpisu.
Dokumentacja ryzyka zawodowego dla Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego to fachowo przygotowany produkt, który zawiera wszystkie najważniejsze i niezbędne elementy. Jest to bardzo dokładny zbiór dokumentów, każde zagrożenie znajduje się na osobnej karcie zagrożeń. Produkt dostępny jest w bardzo atrakcyjnej cenie oraz jest gwarancją pomyślnego przebiegu kontroli przez organy kontrolujące. Klient może być pewien, iż dokumentacja została przygotowana przez specjalistów, którzy posiadają ogromną wiedzą oraz doświadczenie w dziedzinie BHP. Z Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - ocena ryzyka zawodowego metodą PN-N-18002 żadna kontrola nie będzie straszna!
Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego ocena ryzyka zawodowego metodą PN-N-18002 uzyskał wiele pozytywnych opinii w branży. Dokumentacja została przygotowana w sposób rzetelny, dokładny, a co najważniejsze, zgodnie z obecnymi przepisami oraz wytycznymi. Produkt spełnia swoje zadanie, żadna z osób, która zakupiła prezentowaną dokumentację nie została ukarana przez organ kontrolujący jakimkolwiek mandatem. Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego ryzyko zawodowe metodą PN-N-18002 to godny polecenia produkt przygotowany przez specjalistów, którzy bardzo dobrze znają branżę BHP i posiadają spore doświadczenie w przygotowaniu różnych dokumentacji oceny ryzyka zawodowego metodą PN-N-18002 i nie tylko. Co więcej, produkt dostępny jest w dwóch wariantach: elektronicznym oraz drukowanym. Tylko od Ciebie zależy, na który wariant się zdecydujesz. Wariant elektroniczny umożliwia edycję pliku oraz wielokrotny wydruk, co ważne, dokumentację można pobrać już w kilka minut po zakupie. Na życzenie klienta istnieje możliwość wysłania plików w formacie PDF lub OpenOffice. Wariant drukowany to natomiast wersja dokumentacji, która jest gotowa do przedstawienia w czasie kontroli. Wymaga jedynie podpisu.
Dokumentacja ryzyka zawodowego dla Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego to fachowo przygotowany produkt, który zawiera wszystkie najważniejsze i niezbędne elementy. Jest to bardzo dokładny zbiór dokumentów, każde zagrożenie znajduje się na osobnej karcie zagrożeń. Produkt dostępny jest w bardzo atrakcyjnej cenie oraz jest gwarancją pomyślnego przebiegu kontroli przez organy kontrolujące. Klient może być pewien, iż dokumentacja została przygotowana przez specjalistów, którzy posiadają ogromną wiedzą oraz doświadczenie w dziedzinie BHP. Z Inspektor do spraw wytwarzania Głównego Inspektoratu Farmaceutycznego - ocena ryzyka zawodowego metodą PN-N-18002 żadna kontrola nie będzie straszna!
Metoda PN-N-18002
 Niniejsza dokumentacja zawiera szczegółowe informacje i wytyczne dla metody PN-N-18002 zgodnie z tym, jak została opracowana. Opis metody zawiera kolorowe tabelki wartościoiwania poszczególych parametrów dając nie tylko pełne liczbowe odzwierciedlenie tych parametrów, ale również wizualne. Dzięki temu masz pewność, że osoba przeprowadzająca kontrolę (i nie tylko) bez problemu odnajdzie się w treści dokumentacji. Metoda PN-N-18002 jest jedną z najpopularniejszych w metod szacowania ryzyka zawodowego w naszym kraju dlatego z powodzeniem można bazować na tym opracowaniu. PN-N-18002 jest bardzo lubianą metodą przez kontrolujące organy np. takie jak Państwowa Inspekcja Pracy czy Państwowa Inspekcja Sanitarna.
Niniejsza dokumentacja zawiera szczegółowe informacje i wytyczne dla metody PN-N-18002 zgodnie z tym, jak została opracowana. Opis metody zawiera kolorowe tabelki wartościoiwania poszczególych parametrów dając nie tylko pełne liczbowe odzwierciedlenie tych parametrów, ale również wizualne. Dzięki temu masz pewność, że osoba przeprowadzająca kontrolę (i nie tylko) bez problemu odnajdzie się w treści dokumentacji. Metoda PN-N-18002 jest jedną z najpopularniejszych w metod szacowania ryzyka zawodowego w naszym kraju dlatego z powodzeniem można bazować na tym opracowaniu. PN-N-18002 jest bardzo lubianą metodą przez kontrolujące organy np. takie jak Państwowa Inspekcja Pracy czy Państwowa Inspekcja Sanitarna.
